 2021-09-13
2021-09-13 7155
7155
大家好!今天给大家介绍一篇2021年7月发表在Cell Death Discovery(IF:5.241)上的文章。作者对LUAD患者TCGA数据集进行分析,鉴定与预后有关的铁死亡相关lncRNA并构建预后模型(FerRLSig)。该预后模型可以预测LUAD患者的总生存期,免疫微环境和化疗效果。
Identification of a prognostic ferroptosis-related lncRNA signature in the tumor microenvironment of lung adenocarcinoma
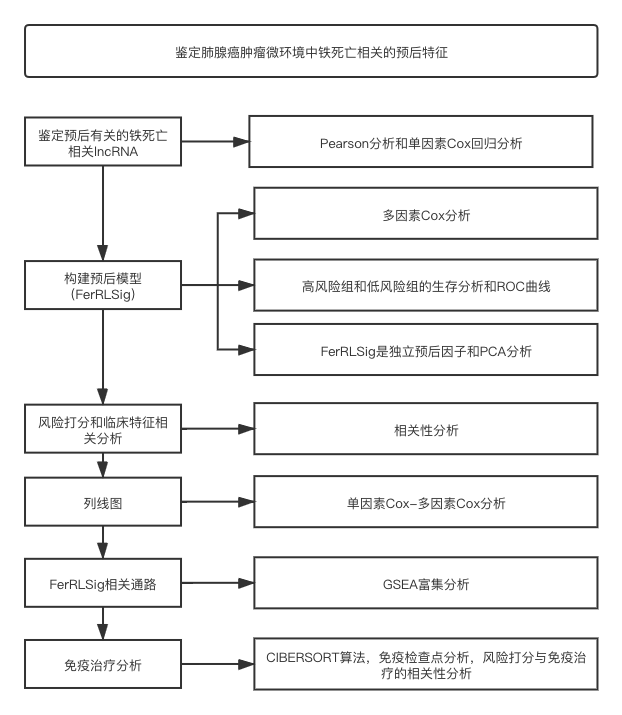
鉴定肺腺癌肿瘤微环境中铁死亡相关的预后特征
01
摘要
铁死亡与多种癌症密切相关,然而参与调控铁死亡相关的因子尚不清楚。本研究中,作者鉴定肺腺癌(LUAD)中铁死亡相关的lncRNAs。作者构建了铁死亡相关的mRNA和lncRNA共表达网络。作者使用单因素和多因素Cox分析构建铁死亡相关lncRNA预后特征(FerRLSig)。该预后模型共有10个铁死亡相关lncRNA。高风险组患者的总生存期较差。作者根据FerRLSig和临床特征构建列线图,可以进行生存风险分层。此外,GSEA分析表明FerRLSig参与多种恶性肿瘤相关的免疫调控通路。根据风险模型,作者发现高风险组和低风险组的免疫状态,化疗和靶向治疗的效果显著不同。这些结果为LUAD的发病机制提供了有用信息。
02
流程图
03
结果
1. 数据集获取和下载
从TCGA数据库下载LUAD的RNA-seq数据和临床数据,共包含535例LUAD样本。
2. 鉴定LUAD中与预后有关的铁死亡相关lncRNA
作者在TCGA LUAD数据集中鉴定到169个铁死亡相关基因,根据Pearson相关分析鉴定到1621个铁死亡相关lncRNA。单因素Cox回归分析表明有21个lncRNA与患者生存期有关(图1A),有7个lncRNA是危险因子,14个lncRNA是保护因子(图1B-1H)。
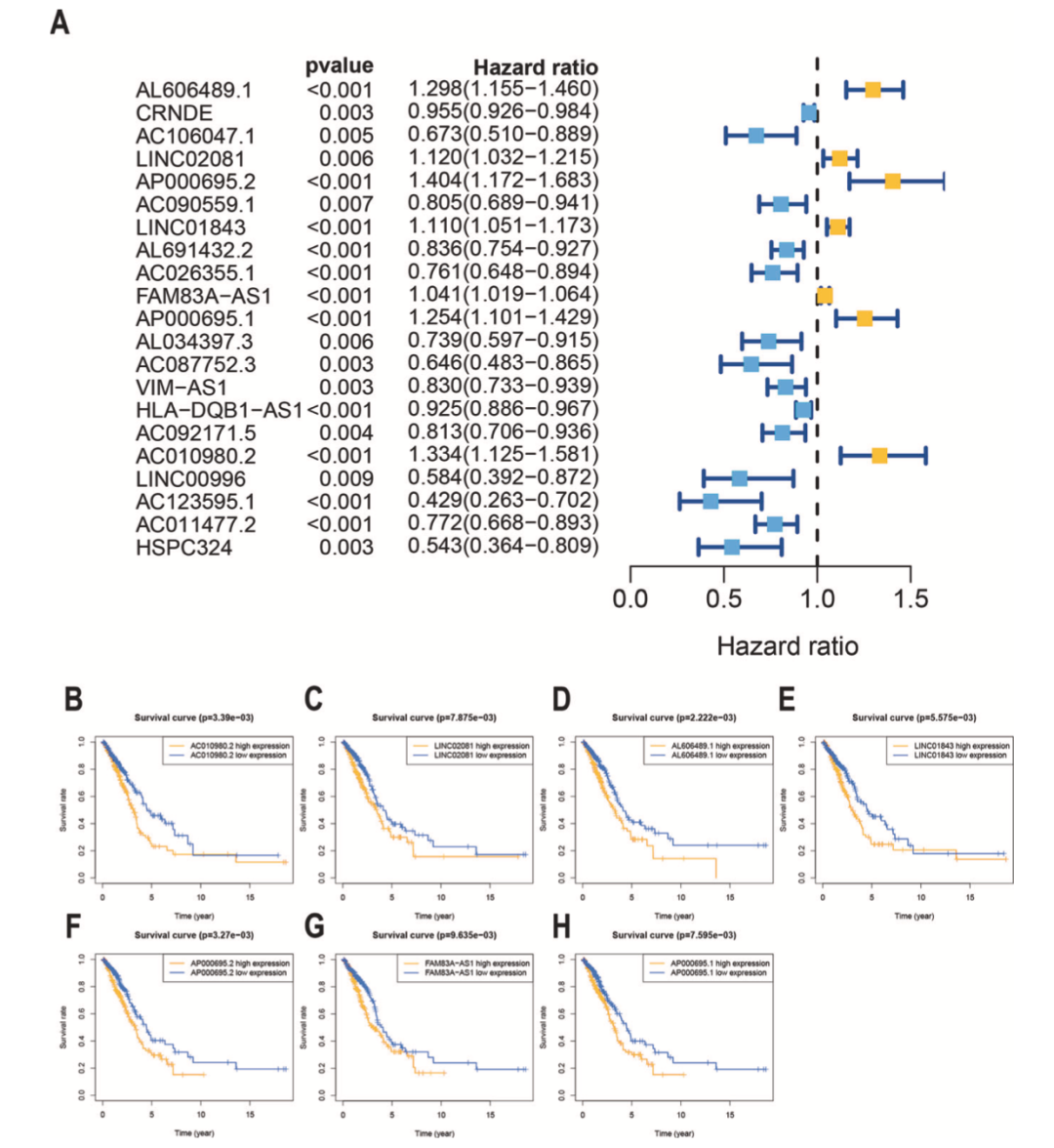
图1 鉴定LUAD中与预后有关的铁死亡相关lncRNA
3. 鉴定铁死亡相关lncRNA的预后特征
随后,作者进行多因素Cox回归分析构建10-铁死亡相关lncRNA预后模型(FerRLSig)。这10个lncRNA与铁死亡基因的相关性如图2A所示。有4个lncRNA是风险因子,6个是保护因子(图2B)。
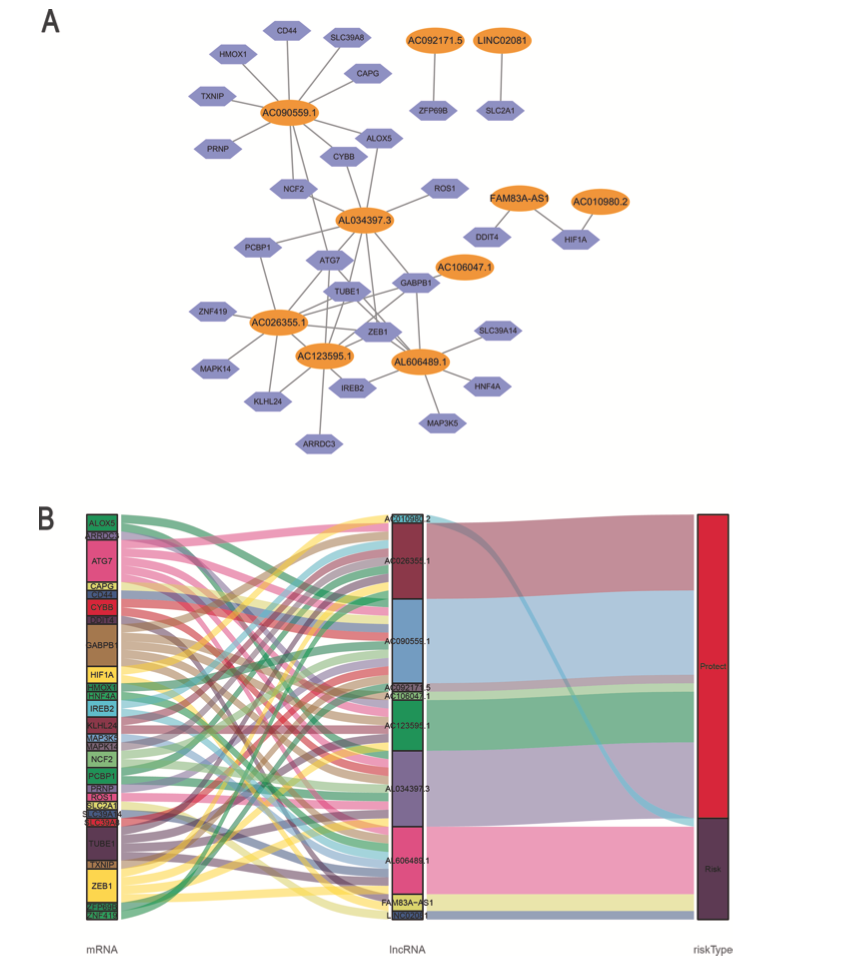
图2 共表达网络和铁死亡相关lncRNA桑基图
风险打分= 0.1567 × AL606489.1+ (−0.2795 × AC106047.1) + (0.1157 × LINC02081) + (−0.2422 × A). (C090559.1) + (−0.24 × AC026355.1) + (0.0207 × FAM83A- AS1) + (−0.1425 × AL034397.3) + (−0.1195 × AC092171.5) + (0.3016 × AC010980.2) + (−0.4327 × AC123595.1)。作者计算患者的风险打分,根据风险打分中位数将患者分为高风险组和低风险组。KM分析表明high-FerRLSig和low-FerRLSig的OS显著不同(图3A),lncRNA表达水平,患者的生存状态和风险打分如图3B-3D所示。
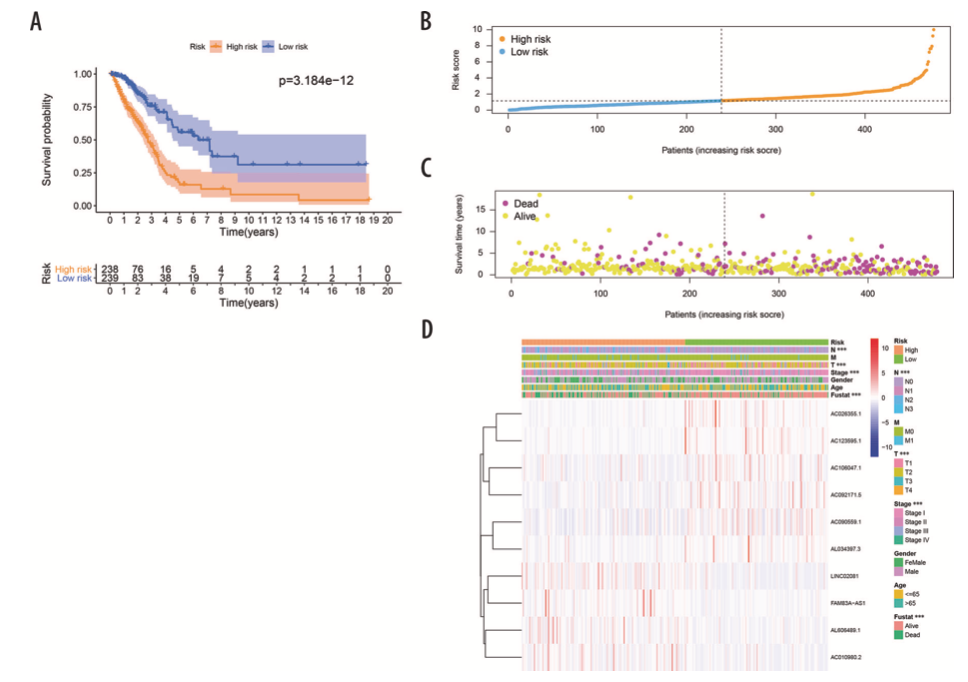
图3 风险模型的预后价值
4. FerRLSig是LUAD的独立预后因子
单因素和多因素Cox分析表明FerRLSig是LUAD患者的独立预后因子(图4A和4B)。1年,3年和5年ROC曲线的AUC分别为0.781,0.712和0.761(图4C)。PCA分析表明根据全基因组和铁死亡lncRNA表达水平不能将高风险组和低风险组分开,然而根据FerRLSig可以将高风险组和低风险组分开,该结果进一步表明了该模型的准确性。这些结果表明FerRLSig是LUAD患者的独立预后风险因子。
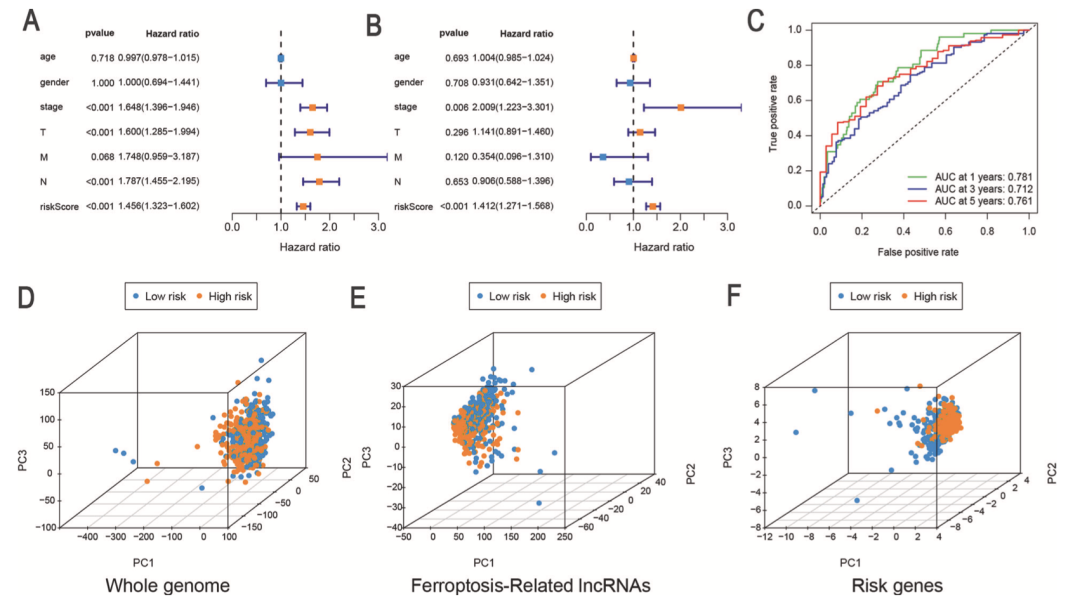
图4 FerRLSig是独立预后因子
5. 风险打分和临床特征的相关性
相关性分析表明风险打分与病理分期显著相关。Ⅱ-Ⅳ分期的风险打分较高(图5A),预后模型与肿瘤分期有关(图5B),发生淋巴结转移的患者风险打分较高(图5C),图5D表明风险打分较高的患者生存情况较差。这些结果表明FerRLSig与LUAD进展和预后相关。
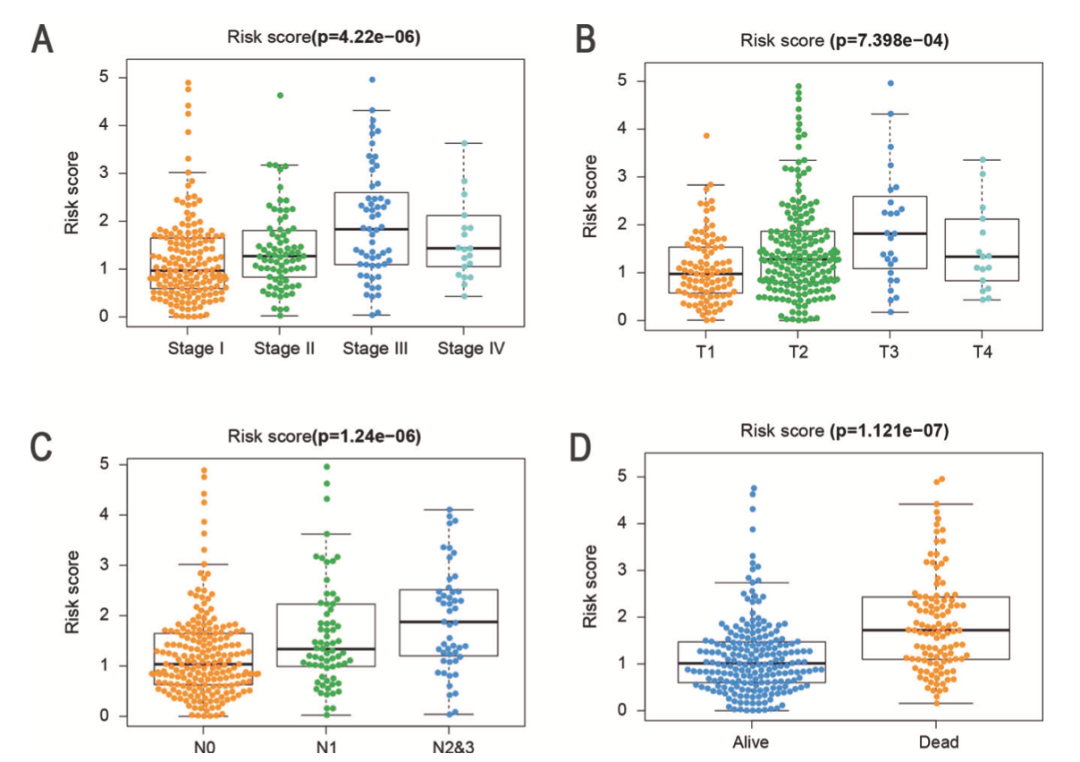
图5 FerRLSig与临床特征有关
6. 构建列线图
作者使用FerRLSig和临床病理特征构建列线图来评估LUAD患者的1年,3年和5年生存情况(图6A)。校准曲线表明列线图准确性较高(图6B-6D)。ROC曲线的5年AUC为0.766,显著高于年龄,性别,肿瘤分期,T分期等特征(图6E)。
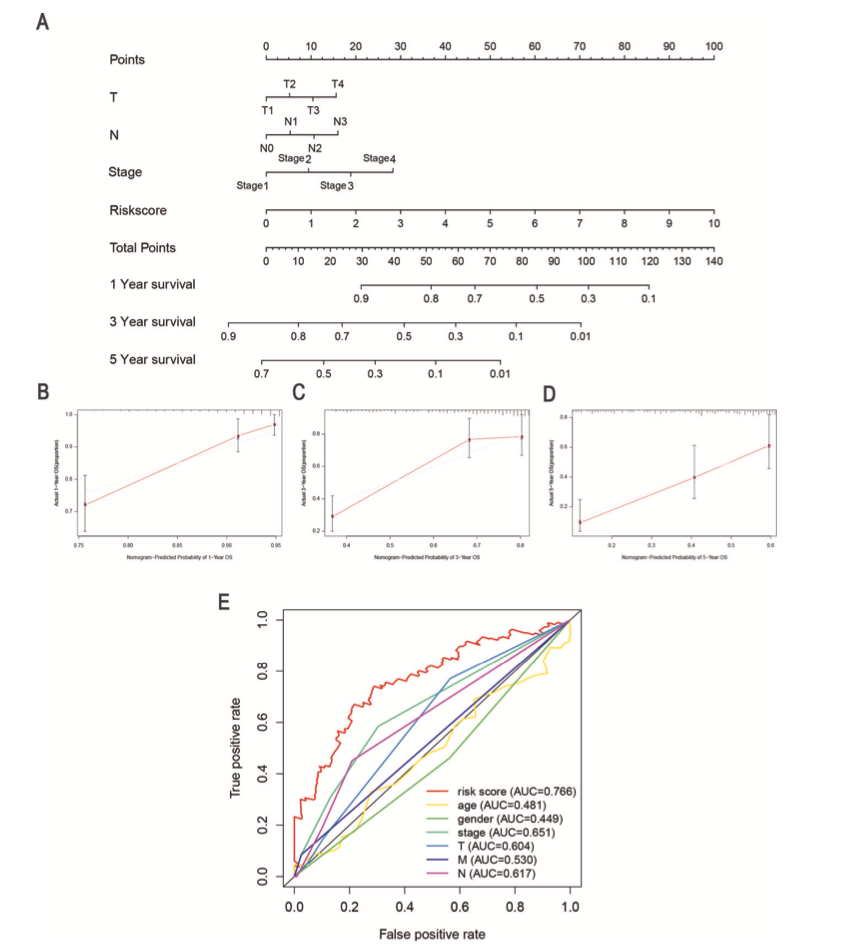
图6 列线图
7. 鉴定FerRLSig相关的生物学通路
作者使用GSEA进行功能富集分析,先天免疫反应激活信号通路,白介素1介导的信号通路,凋亡信号通路等显著富集于高风险组的LUAD患者,CD8+αβT细胞激活,T细胞介导免疫,MAST细胞介导免疫等显著富集于低风险组的LUAD患者(图7A)。此外,细胞周期和p53信号通路等显著富集于高风险组,自身免疫性甲状腺疾病等显著富集于低风险组(图7B)。这些结果表明,预后模型中的lncRNA可能参与肿瘤免疫微环境。
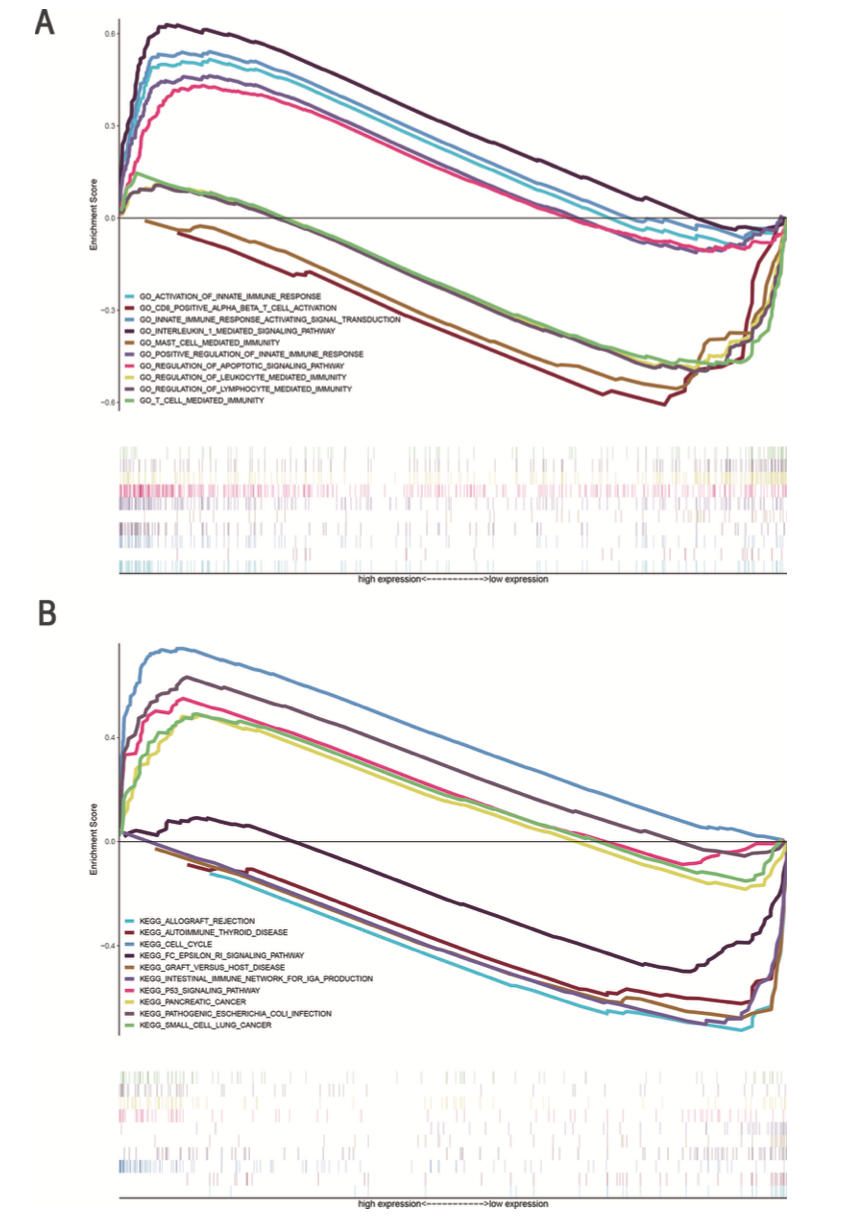
图7 GSEA富集分析
8. 高风险组和低风险组的免疫治疗,化疗和靶向治疗反应的差异
为评估风险打分与肿瘤免疫细胞浸润的关系,作者使用CIBERSORT计算两个风险组22种免疫细胞的比例。高风险组中激活记忆CD4 T细胞,M0巨噬细胞,M1巨噬细胞和激活肥大细胞比例较高,而记忆B细胞,浆细胞,单核细胞,静息树突细胞,静息肥大细胞与风险打分负相关(图8A)。随后,作者分析免疫检查点在两个风险亚组中的表达水平,低风险组中有25个免疫检查点高表达而高风险组中有4个免疫检查点高表达(图8B)。此外,作者评估风险打分与靶向治疗和化疗药物反应的关系。低风险组对靶向治疗药物吉非替尼和厄洛替尼高度敏感。低风险组对化疗药物紫杉醇,多西他赛和吉西他滨等高度敏感。以上结果表明FerRLSig是预测化疗敏感性的预测因子。
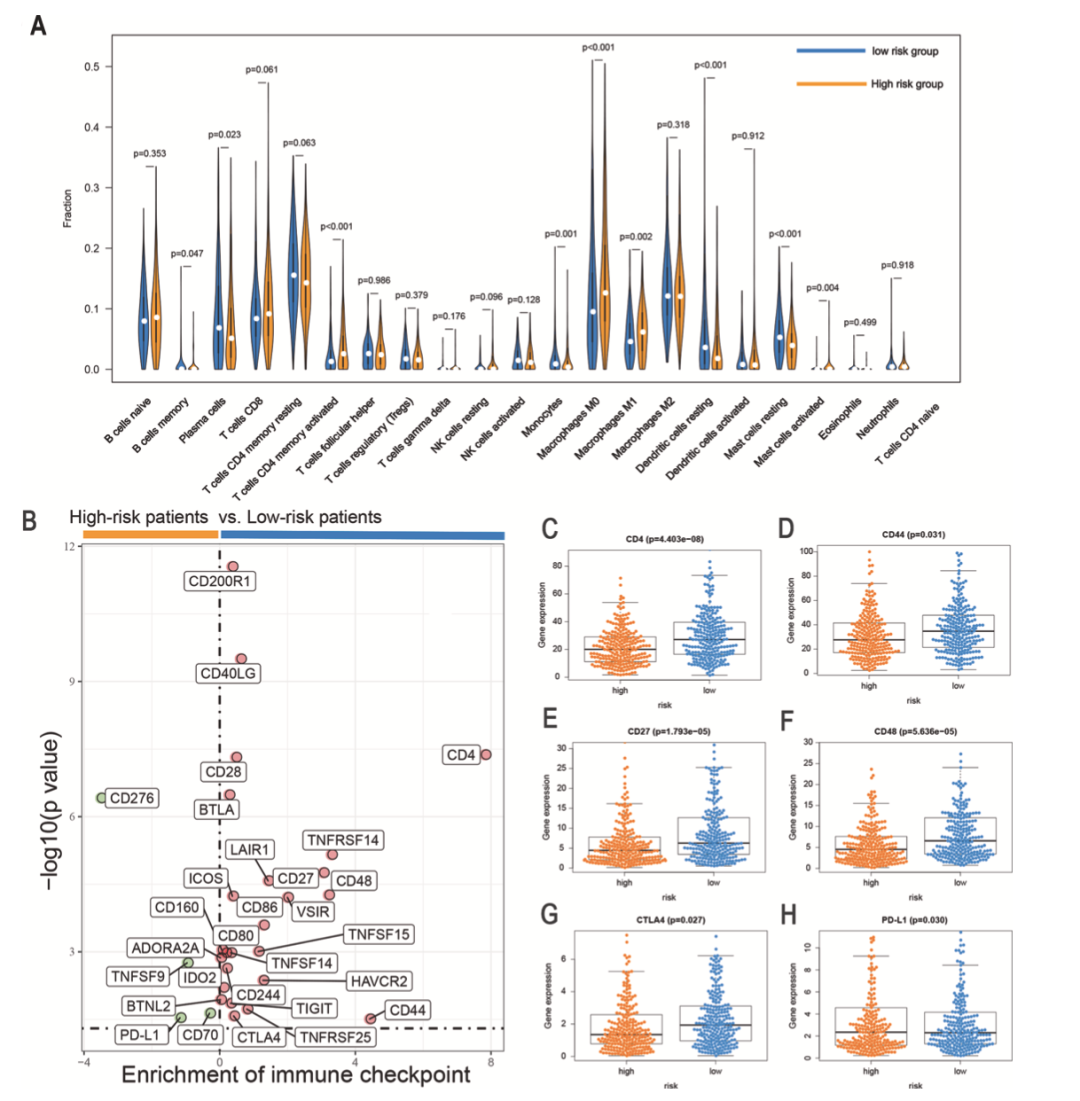
图8 高风险组和低风险组的免疫微环境和化疗反应分析
04
结论
总的来说,作者对TCGA数据集进行分析,构建10-铁死亡相关lncRNA预后模型(FerRLSig),该预后模型可以预测LUAD患者的总生存期。作者根据FerRLSig和临床病理特征构建列线图,可以准确预测患者1年,3年和5年的总生存期。此外,作者分析高风险组和低风险组与免疫微环境和化疗反应的关系。本研究为今后LUAD患者的临床诊断和个性化治疗提供有价值信息。本研究的局限性在于作者没有使用额外数据集对FerRLSig进行验证。
版权声明:本文转自“生信发文助手”,文章转载只为学术传播,不代表本号观点,无商业用途,版权归原作者所有,如涉及侵权问题,请联系我们,我们将及时修改或删除。
 学术互动
学术互动

添加微信获取最新优惠、出版政策、课程直播信息,随时咨询客服/编辑,了解更多实时资讯



